Un médicament biosimilaire, c’est quoi ?
Un biosimilaire est un biomédicament approuvé sur la base de la démonstration d’une similarité par rapport au médicament biologique existant, connu comme le biomédicament de référence. Le terme « bio » indique qu’il est issu du vivant, par exemple d’une protéine, et « similaire » qu’il est cliniquement équivalent à un médicament biologique de référence qui a déjà une autorisation de mise sur le marché (AMM) et dont le brevet est tombé dans le domaine public1.
L’AMM d’un médicament biosimilaire répond à des exigences réglementaires strictes afin de démontrer son équivalence clinique au médicament biologique de référence en termes de qualité, de caractéristiques physico-chimiques, de sécurité et d’efficacité1. Un médicament biosimilaire dispose des mêmes indications et des mêmes modalités d’utilisation (mêmes doses et mêmes schémas d’administration) que son médicament biologique de référence1.
En France, les médecins autorisés à prescrire le médicament biologique de référence ont la possibilité de le remplacer par un autre médicament biologique similaire à tout moment du traitement. C'est ce que l'on appelle l'interchangeabilité2.
À lire aussi
La biotechnologie repose sur des technologies de pointe, telle que la génétique humaine, qui permettent de caractériser les mécanismes moléculaires à l’origine des maladies.
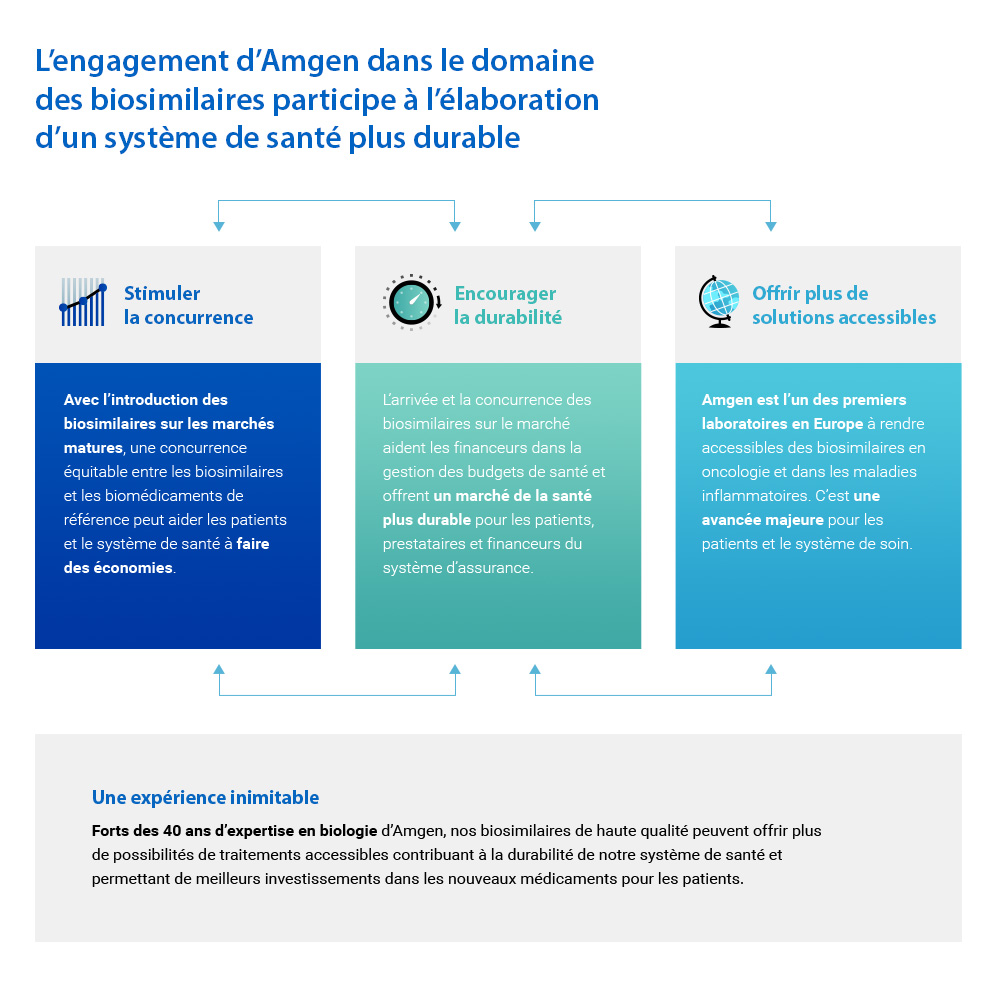
Notre engagement dans les biosimilaires : des impacts positifs pour les patients et les systèmes de santé
Nous disposons d’une expertise reconnue dans le domaine des biosimilaires et avons investi près de 1,8 milliard d’euros pour le développement de 6 molécules biosimilaires en oncologie-hématologie, dans les maladies inflammatoires, en ophtalmologie avec pour ambition de les commercialiser d’ici à 2025 sur le marché européen. Trois d’entre elles ont d’ores et déjà obtenu une AMM européenne et sont commercialisées en France.
Le développement de produits biologiques, y compris les biosimilaires, exige des connaissances hautement spécialisées. Chez Amgen, nous utilisons le même réseau de scientifiques et les mêmes installations de pointe pour développer et fabriquer nos médicaments biosimilaires que pour nos produits biologiques innovants.
Cela signifie que nos biosimilaires respectent les mêmes processus et les mêmes normes de qualité que nos produits biologiques.
Le développement d'un médicament biosimilaire avoisine les 8 à 10 ans et son coût est compris entre 100 et 200 millions de dollars3, alors que le développement d'un nouveau médicament est estimé à 2,6 milliards de dollars4. Les biosimilaires peuvent bénéficier à presque toutes les parties prenantes du système de santé en proposant davantage d'options de traitement aux patients5 et en constituant une offre de traitement de qualité à des prix plus abordables6.
Tout en contribuant à la durabilité de nos systèmes de santé, les biosimilaires permettent également d’investir davantage dans la découverte de traitements innovants pour les pathologies où les besoins restent insatisfaits.
Nous sommes également engagés dans l’amélioration de la prise en charge des patients et dans l’accès aux biosimilaires en menant et en participant à plusieurs initiatives :
Nous avons par exemple participé à l’enquête sociologique « Rechercher par un questionnaire anonyme les facteurs susceptibles de freiner l’adhésion du patient atteint de MICI au traitement par biomédicaments dans le cadre d’un parcours de soins organisé en ambulatoire » et avons été impliqués dans une recherche de solutions concrètes pour sécuriser le parcours de soin des patients sous biomédicament (menée en collaboration avec les Centres Hospitaliers Universitaires de Bordeaux et de Montpellier fin 2020)
Amgen’s leadership in biosimilars is helping to develop a more sustainable healthcare ; https://www.amgenbiosimilars.com/-/media/Themes/Amgen/amgenbiosimilars-com/Amgenbiosimilars-com/pdf/v1/value-proposition-infographic.pdf
Améliorer l’accès aux biosimilaires
L’accès aux biosimilaires représente un intérêt de santé publique en facilitant et garantissant l’accès des patients à l’innovation, en limitant les ruptures, et un intérêt économique en stimulant la concurrence et diminuant ainsi les dépenses de santé.
Cependant, les médicaments biosimilaires restent sous-utilisés en France. Avec 69 % de pénétration à l’hôpital et seulement 23 % en ville, ce marché est encore loin de l’objectif de 80 % de recours aux biosimilaires en 2022 fixé dans la Stratégie nationale de santé7.
En effet, chez les patients atteints de maladies chroniques, l’initiation d’un traitement avec un biosimilaire ne représente que 15 à 21 % des prescriptions. Et si la pénétration à l’hôpital est très rapide après l’arrivée d’un biosimilaire sur le marché (supérieure à 90 %), le taux de pénétration en ville reste parmi les plus bas d’Europe8.
Amgen France propose trois leviers pour favoriser l’accès des biosimilaires et rappelle que seule la décision médicale partagée lors d’un échange entre le médecin et le patient permettra de le respecter :
- Faire de la pédagogie pour favoriser la décision médicale partagée ;
- En ville, développer l’interchangeabilité ;
- A l’hôpital, contribuer à un modèle pérenne.
À lire aussi
Découvrez nos 3 propositions pour améliorer l’accès aux biosimilaires en France.
Sources
1Haute Autorité de Santé : Qu’est-ce qu’un médicament biosimilaire ? En ligne. https://www.has-sante.fr/jcms/c_2807411/fr/les-medicaments-biosimilaires. Consulté le 02 février 2024.
2Biosimilars in the EU, Information guide for healthcare professionals. En ligne. https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_en.pdf. Consulté le 02 février 2024.
3En ligne. Winning with biosimilars, Opportunities in global markets https://www2.deloitte.com/content/dam/Deloitte/us/Documents/life-sciences-health-care/us-lshc-biosimilars-whitepaper-final.pdf. Consulté le 02 février 2024.
4En ligne. Innovation in the pharmaceutical industry: New estimates of R&D costs : https://pubmed.ncbi.nlm.nih.gov/26928437/ Consulté le 02 février 2024.
5The Center For Biosimilars. Biosimilars market is ripe for cost savings.
https://www.centerforbiosimilars.com/view/biosimilars-market-is-ripe-for-cost-savings Consulté le 02 février 2024.
6The Biosimilars Council. Biosimilars in the United States. http://biosimilarscouncil.org/wp-content/uploads/2019/03/Biosimilars-Council-Patient-Access-Study.pdf. Consulté le 02 février 2024.
7En ligne. http://www.medicamentsgeneriques.info/medicaments-generiques-2020-une-annee-pas-comme-les-autres. Consulté le 02 février 2024.
8En ligne : https://solidarites-sante.gouv.fr/IMG/pdf/dossier_sns_2017_vdef.pdf Consulté le 02 février 2024.


